简单分析初中化学“优先反应原则”
前言
作为一名扑街初中生,在老师灌输优先反应原则时总是有点疑惑——化学反应不应该是同步进行的吗?
这个问题大抵是伴随了我整个九年级。近期才想明白,现将拙见分享出来,权以抛砖引玉罢。
优先反应的原则
在初中化学解题和教学中,一般把化学反应认定为有顺序依次发生。具体如下:
- 在金属与盐溶液或稀酸发生置换反应时,根据教材中的 金属活动性顺序表 [注1],排在前面的金属优先。
- 在酸碱盐溶液发生反应时,按照 中和反应 -> 生成气体的反应 -> 生成沉淀的反应 的优先顺序进行。
[注1]金属活动性顺序表:K > Na > Ca > Mg > Al > Zn > Fe > Sn > Pb > (H)[注2] > Cu > Hg > Ag > Pt > Au
[注2]此处 氢 表示在氢之前的金属单质可以置换出稀酸里的氢离子
置换反应中的优先反应
【题目】往一定量铁粉和铝粉的混合物中加入足量稀盐酸,记录产生氢气的质量与时间的关系,绘制图象如下:
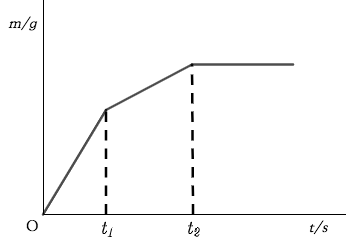
- 0~t1时刻内发生的反应方程式是________________。
- t1~t2时刻内反应容器中的现象是_________________。
【答案】1. 2Al + 6HCl = 2AlCl3 + 3H2↑ 2.溶液变成浅绿色,有气泡冒出,固体逐渐消失
我们可以看到,在题目中认为铝与稀盐酸先反应,而铁不参与反应;在铝反应殆尽之后铁才加入反应,此时溶液内才开始出现显浅绿色的 FeCl2 。
酸碱盐复分解反应中的优先反应
【题目】( 2015 贵阳中考真题)在实验室,某同学将氢氧化钠溶液逐滴滴入硫酸和硫酸铜的混合溶液中,直至过量。加入氢氧化钠溶液的质量(横轴)与混合溶液中溶质质量(纵轴)的关系如图所示。(题目提问略)
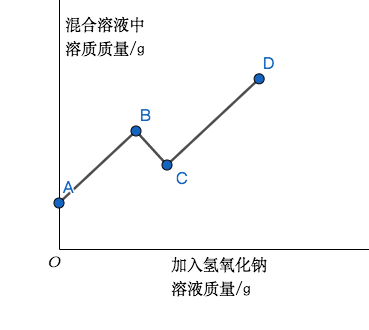
可以看见图像被分成了三段。其中 BC 段因为溶质质量减少,可以结合反应物很容易地判断出来发生的反应方程式是 2NaOH + CuSO4 = Na2SO4 + Cu(OH)2 ↓,生成氢氧化铜沉淀。
所以,易得,在AB段进行的仅是 NaOH 与 H2SO4 的酸碱中和反应,而因为在BC端才开始生成沉淀,NaOH 与 CuSO4 的反应到BC端才开始进行。
原因
假如我们做实际实验,也会看到类似的现象。这说明化学老师的教学是正确的。但理论上化学反应应该是同时进行,为什么会出现优先反应的情况呢?
金属置换反应的优先真相
我们知道,在金属盐的可溶性溶液中,加入了活动性强于该金属的金属单质,盐中的金属离子将会被该金属单质置换出溶液。而活泼性越强的金属单质,进行这一反应的速度越快。
本质
因此我们可以发现,在多种金属单质置换同一金属盐溶液时,活泼性强的金属优先的本质是这三个反应同时发生:
- 强金属单质进行置换反应。
- 弱金属单质进行置换反应。
- 活泼性弱的金属置换出的盐溶液被活泼性强的金属置换,弱金属离子转成正常原子。
而 反应 3 发生的速度,因为参与反应的金属单质要比 反应 2 中参与反应的金属单质强,因此比 反应 2 速度更快。
例子
让我们捏造三种金属元素 X Y Z (化合价都为 +1 ,活动性顺序: X > Y > Z )和一种酸根离子 M (化合价为 -1 )。
将 X Y 单质加入 ZM 溶液中,同时发生了三种反应:
- X + ZM = Z + XM
- Y + ZM = Z + YM
- X + YM = Y + XM
由于 X 比 Y 更活泼,因此 反应 3 比 反应 2 更快,YM 刚刚生成完毕就被 X 反应了。因此从宏观上来看,反应 2 就好似从来没有发生。
酸碱盐反应的优先真相
中和反应
中和反应的优先发生,是因为 H+ 与 OH- 的反应热情比较大,而其反应的结果不是离子化合物。
因此,三个反应(中和反应、生成气体的反应、生成沉淀的反应)同时发生,但由于后二者都能生成碱(在能发生中和反应的情况下),因此生成的碱中的 OH- 被没反应完的酸中的 H+ 夺走生成了水分子[1],因此宏观上就呈现出后两者反应没有发生过的假象。
生成气体的反应
生成气体的反应比较优先,因为气体的生成相对瞬时;而沉淀的生成,由于物理学上的扩散作用,会相对缓慢。
仍在溶液中,还没来得及沉淀的沉淀物质,其部分离子被生成气体的反应夺走,因此宏观上也就呈现出一种沉淀从未生成的假象。
后记
这篇文章是按照初中生能想出来的最好的组织方式来写的,如有不妥见谅。
这篇文章只参考了一篇论文,剩下都是我自己摸索出来的。作为一个初中生,我的结论难免有谬误之处:期盼您的斧正。
最后,这篇文章为了帮助即将中考的九年级学生更好地掌握题目,而不是知其然不知其所以然。希望我能帮助你
——中考加油!
参考
[1] 杜忠安.在初中化学教学中,对“酸碱中和反应优先”的异议[J].学校教育研究,2015(23)

